教育
Education
研究活動
研究内容
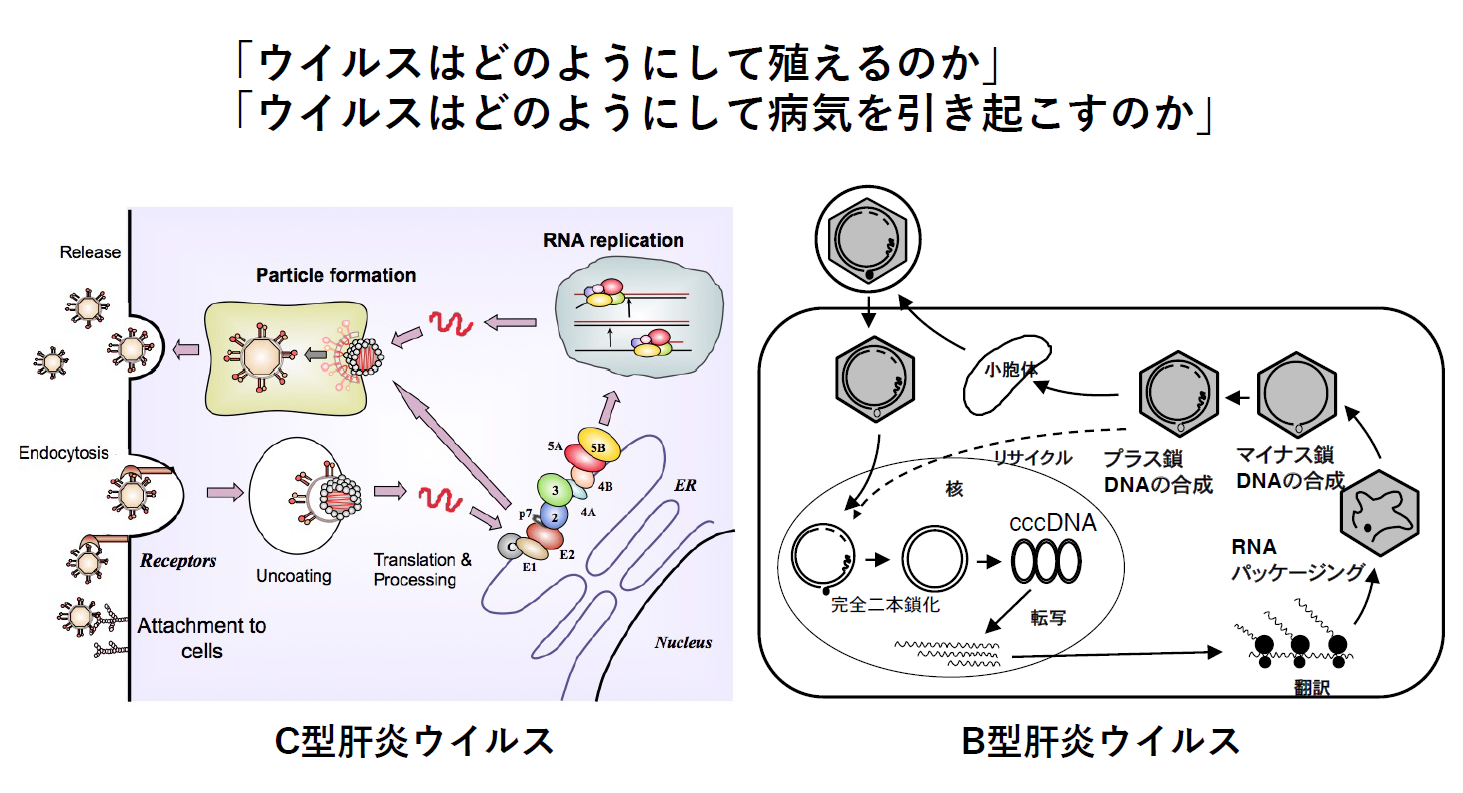
ウイルス性肝疾患の病態機構に関する研究
B型肝炎ウイルス(HBV)、C型肝炎ウイルス(HCV)の持続感染は慢性炎症、肝臓の線維化、がん化を引き起こすが、ウイルス感染に起因する肝線維化、肝発癌の分子機構は必ずしも十分に解明されていない。HCV感染では脂質、鉄など種々の代謝系が異常をきたすことが知られているがその分子機構は未だ不明な点が多い。ウイルス感染またはウイルス遺伝子が発現する細胞における環境攪乱の解析、およびウイルス遺伝子発現マウスモデルを使った実験でHBVまたはHCVの病原性発現機構を明らかにする研究を行っている。
肝炎ウイルスの複製増殖機構に関する研究
HCVのライフサイクルの諸過程に関与するウイルス-宿主因子相互作用などは明らかにされつつあるが、各過程がどのように調節制御されているかはまだ不明な点が多く残されている。また、このウイルスが「どうしてヒトの肝臓に選択的に感染し増殖するのか」は明らかではない。最終的にこの質問にはっきり答えられるようにすべく、HCVの感染増殖の機構を分子レベルで明らかにする研究を推進している。
HBVは、感染後に防御抗体(HBs抗体)が陽性化した後においてもウイルスDNAが潜在化し、基本的にその排除が困難なことがB型肝炎対策の最大の問題となっている。一般に、ウイルス(特にDNAウイルス)持続感染においてゲノム潜在化と潜伏状態からの活性化機構は極めて重要なウイルス生存戦略であるがその制御機構は不明な点が多い。ウイルス生活環を制御するエピゲノム情報が宿主細胞内でどのように安定保持されているかは全く明らかにされていない。HBVのゲノム潜伏化、活性化に重要なエピゲノム制御機構を解明するため、持続感染細胞でHBV ゲノムと会合する宿主因子を探索、同定しその機能を解明する実験を進めている。
HBVの転写後調節機構に注目し、HBV mRNAのスプライシング、核外輸送、分解をそれぞれ制御する機構を明らかにする研究を行っている。
フラビウイルスの研究
フラビウイルス科フラビウイルス属の中には、デングウイルス、ジカウイルス、ウエストナイルウイルスなど蚊を媒介とし公衆衛生上問題となる感染症の原因ウイルスが含まれる。蚊媒介性ウイルス感染症に対する対策を確立する上で、効果的な媒介蚊駆除法の策定は重要である。近年開発改良が進んでいる組織透明化技術を駆使して、内部構造を可視化した感染蚊を作製し個体全体の構造を保持した状態でウイルス体内動態を詳細に解析する研究を進めている。
ジカウイルスは、2015年以降、アメリカ大陸で流行が発生し現在推計約1億万人が感染しているとされ、本邦においても輸入症例報告が蓄積されている。一般に健常人での感染における病態はデングウイルス等に比べ重篤な症例は少ないとされているが、小頭症との関連は世界的に示されており、妊娠初期に妊婦がジカウイルスに感染すると小頭症児発生のリスクが高くなる可能性が明らかになっている。このような病態発症を防ぐためには、妊婦や胎児への感染メカニズム、小頭症発症機序の全容解明が重要である。小型霊長類のコモンマーモセットを用いてジカウイルスの感染病態モデルを確立し、親動物および胎児における病態を解明しその発症機序の解明につながる研究を進めている。
抗ウイルス薬の開発
コロナウイルスのみならず、蚊媒介性フラビウイルス、インフルエンザウイルスなど新興再興感染症、またウイルス肝炎など慢性感染症に有効な治療薬が求められている。ウイルス阻害剤は、ウイルスタンパク質の機能などを標的とした個別のウイルス特異的な薬剤の開発が基本であり、ウイルスライフサイクル制御の分子機構研究の成果を基盤として新たな創薬標的を見出し既存薬とは作用機序の異なる特異的阻害剤の開発を目指している。
一方、種々のウイルス種に有効な阻害剤を開発することができていれば、新たなウイルス感染症が出現した際、いち早く感染対策に利用できる可能性がある。種々のウイルス感染で発現亢進し、ウイルス複製増殖に必要な宿主代謝系因子を標的とした発現抑制物質は、広範なウイルス種に阻害効果を示す可能性が期待される。このような宿主細胞因子の発現制御物質の探索を行っている。

